Dra. Ana Inês Costa Bronchteim
História clínica:
W. L. S., masculino, 40 anos, empresário, casado, natural do RJ.
QP: Cansaço aos esforços habituais (maratonista)
HDA: Relata dispnéia aos grandes esforços, com evolução para médios esforços de início há três meses associada à linfadenopatia disseminada.
Nega febre e/ou perda ponderal.
Cansaço foi inicialmente percebido durante a prática de corridas de longa distância (paciente corria 2 horas e passou a não suportar mais de 1 hora).
Nega síncope e/ou pré-síncope. Nega cansaço em repouso.
HPP: previamente hígido. Sem uso regular de medicações.
Hfam negativa para morte súbita (MS) e/ou DAC.
Ex físico
Lúcido, orientado, eupneico, corado, anictérico, acianótico, hidratado, afebril.
Presença de gânglios palpáveis em região cervical e retro-auricular, não dolorosos.
RCI 2T BNF s/sopros
Pulmões com MV universalmente audível e crepitações bibasais
PA 120x 70 mmHg FC 43 bpm Sat O2 98%
Abdome e membros: NDN.
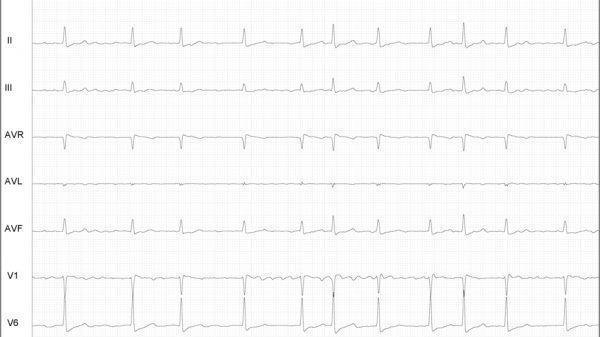
ECG: Presença de ritmo sinusal e padrão de BRE com BDAS apresentando bloqueio AV de 1º grau e BAV 2:1 alternando com períodos de BAVT e mudança de polaridade do complexo QRS.
Rx tórax: Padrão intersticial bilateral com presença de nódulos parahilares sugestivos de aumento de linfonodos.
HOLTER 24 horas
Presença de ritmo sinusal com condução AV 1:1 e intervalos PR alargados (BAV 1º grau);
BAV 2º grau MI, períodos de BAV 2:1 com QRS estreito e períodos de BAVT com alargamento do QRS durante a vigília e sono.
FC mínima de 34 bpm (sono); máxima de 85 e média de 69 bpm.
Ausência de ectopias atriais e/ventriculares. Ausência de taquiarritmias.
Tomografia de tórax com padrão de aumento ganglionar sugestivo de sarcoidos e pulmonar.

Fig. 4 – Tomografia de alta resolução do tórax
Ressonância magnética cardíaca: Hipertrofia VE moderada-importante localizada em septo basal compatível com fibrose associada à granuloma.
Ausência de remodelamento do VE
Realce tardio após gadolíneo.
Portanto, até este ponto da investigação, existe uma alta suspeição clínica de tratar-se de um quadro de sarcoidose cardíaca com envolvimento extra-cardíaco em paciente jovem, atleta e com distúrbio avançado da condução elétrica intramiocárdica pela presença de fibrose em região septal onde o sistema elétrico de condução está presente, com possibilidade de piora da bradiarritmia com instabilidade hemodinâmica e risco de arritmia ventricular sustentada pelo aparecimento de circuitos de reentrada em torno da área de fibrose, taquiarritmia ventricular sustentada e elevado risco de morte súbita cardíaca.
Conduta clínica:
Conforme resumido no fluxograma abaixo, a literatura recomenda que pacientes sem história prévia de sarcoidose sistêmica ou cardíaca e com idade < 60 anos que apresentam BAV 2º grau ou BAVT ou Taquicardia ventricular sustentada ou insuficiência cardíaca diastólica inexplicada devam realizar ressonância cardíaca ou 18 F-FDG PET ou cintilografia de estresse e repouso com sestamibi ou tálio 201 + gálio 67 (modalidade I) e tomografia de tórax de alta resolução (modalidade II).
Se as modalidades I ou II forem positivas como no caso acima descrito, a biópsia deve ser considerada antes do início da corticoterapia.
O tratamento clínico deve ser instituído antes da decisão de indicação ou não de marcapasso definitivo, pois estamos lidando com um processo inflamatório que pode ser reversível sem implante do MP.

Fig 6 – Fluxograma – suspeita de sarcoidose clínica
Dessa forma, o paciente realizou a biópsia ganglionar que mostrou padrão granulomatoso e foi submetido à broncoscopia com biópsia transbrônquica que confirmou padrão granulomatoso não caseoso compatível com sarcoidose.
Realizou ecocardiograma que mostrou função de VE normal sem alteração segmentar e cintigrafia miocárdica com Gálio 67 (SPECT) de corpo inteiro sugestiva de processo inflamatório em atividade no coração (SIV), linfonodos hilares e glândula submandibular à esquerda.
Conclusão: Sarcoidose extra-cardíaca com envolvimento miocárdico importante sem disfunção ventricular e em vigência de atividade inflamatória.
Decidido então pelo tratamento inicialmente farmacológico: Imunossupressão com corticóides: sarcoidose cardíaca em atividade – prednisona 30 mg ao dia ou 60 mg em dias alternados por 8-12 semanas cujas evidências recentes sugerem que o tratamento em fases iniciais, antes da presença de disfunção ventricular tem um impacto positivo na redução da mortalidade e melhora da função ventricular em longo prazo.
No entanto, apesar do início da corticoterapia, não podemos esquecer que existe fibrose não reversível em região septal baixa que pode gerar distúrbios elétricos fixos e irreversíveis com risco de arritmia ventricular sustentada e morte súbita.
Neste caso, dados da literatura demonstram que em vigência de sarcoidose cardíaca com acometimento também em outros órgãos e presença de BAVT é fundamental o implante de cardioversor-desfibrilador- implantável (CDI) nos casos sem disfunção ventricular esquerda e implante de ressincronizador cardíaco nos casos com disfunção grave e dissincronismo intra e interventricular documentado (vide figura abaixo)

Fig 7 – Fluxograma diagnóstico na sarcoidose
O paciente foi submetido a implante de CDI pela presença de acometimento fibrótico significativo na RNM que pode gerar taquicardia ventricular sustentada e morte súbita cardíaca.
Esta conduta está baseada em diretriz americana (American college of cardiology and american heart association (ACC/AHA) 2008 – Indicação classe IIa (possivelmente benéfico).
Efficacy and safety of implantable cardiac
defibrillators for treatment of ventricular
arrhythmias in patients with cardiac sarcoidosisEuropace (2013) 15, 347–354
References
1. Statement on sarcoidosis. Joint Statement of the American Thoracic Society
(ATS), the European Respiratory Society (ERS) and theWorld Association of Sarcoidosis
and Other Granulomatous Disorders (WASOG) adopted by the ATS
Board of Directors and by the ERS Executive Committee, February 1999. Am J
Respir Crit Care Med 1999;160:736–55.
2. Perry A, Vuitch F. Causes of death in patients with sarcoidosis. A morphologic
study of 38 autopsies with clinicopathologic correlations. Arch Pathol Lab Med
1995;119:167–72.
3. Iwai K, Sekiguti M, Hosoda Y, DeRemee RA, Tazelaar HD, Sharma OP et al. Racial
difference in cardiac sarcoidosis incidence observed at autopsy. Sarcoidosis 1994;
11:26–31.
4. Epstein AE, Dimarco JP, Ellenbogen KA, Estes NA 3rd, Freedman RA, Gettes LS
et al. ACC/AHA/HRS 2008 Guidelines for device-based therapy of cardiac rhythm
abnormalities. Heart Rhythm 2008;5:e1–62.
5. Kron J, Sauer W, Schuller J, Bogun F, Crawford T, Sarsam S et al. Efficacy and
safety of implantable cardiac defibrillators for treatment of ventricular arrhythmias
in patients with cardiac sarcoidosis. Europace 2013;15:347–54.
6. Schuller JL, Zipse M, Crawford T, Bogun F, Beshai J, Patel AR et al. Implantable
cardioverter defibrillator therapy in patients with cardiac sarcoidosis. J Cardiovasc
Electrophysiol 2012;23:925–9.
7. Betensky BP, Tschabrunn CM, Zado ES, Goldberg LR, Marchlinski FE, Garcia FC
et al. Long-term follow-up of patients with cardiac sarcoidosis and implantable
cardioverter-defibrillators. Heart Rhythm 2012;9:884–91.
8. Bardy GH, Lee KL, Mark DB, Poole JE, Packer DL, Boineau R et al. Amiodarone or
an implantable cardioverter-defibrillator for congestive heart failure. N Engl J Med
2005;352:225–37.
9. Mehta D, Mori N, Goldbarg SH, Lubitz S, Wisnivesky JP, Teirstein A. Primary prevention
of sudden cardiac death in silent cardiac sarcoidosis: role of programmed
ventricular stimulation. Circ Arrhythm Electrophysiol 2011;4:43–8.
10. Aizer A, Stern EH, Gomes JA, Teirstein AS, Eckart RE, Mehta D. Usefulness of
programmed ventricular stimulation in predicting future arrhythmic events in
patients with cardiac sarcoidosis. Am J Cardiol 2005;96:276–82.
11. Bradley B, Branley HM, Egan JJ, Greaves MS, Hansell DM, Harrison NK et al. Interstitial
lung disease guideline: the British Thoracic Society in collaboration with the
Thoracic Society of Australia and New Zealand and the Irish Thoracic Society.
Thorax 2008;63(Suppl. 5):v1–58.
310 Editorial