Roberto Coury Pedrosa
Clarissa Antunes Thiers
João Luis Barbosa
INTRODUÇÃO
Por se tratar de uma doença debilitante e incurável, a doença de Chagas constitui ainda hoje, em um Brasil praticamente livre de transmissão pelo vetor, um grave problema de saúde pública, especialmente pelo tratamento dos pacientes já infectados no passado. Estima-se que, especificamente no Brasil, cerca de 3 a 5 milhões de pessoas encontram-se infectadas pelo T. Cruzi (DIAS, 2007).
Segundo dados da Organização Mundial de Saúde, ainda que a transmissão vetorial tenha sido interrompida em países como o Brasil, Chile e Uruguai, a prevalência de doentes com cardiopatia chagásica crônica foi estimada em 18 a 20 milhões de indivíduos na América Latina, com 300.000 novos casos a cada ano e 50.000 mortes anuais associadas à doença (GELB, 2002; ENGELS, 2006). De acordo com dados da FUNASA e FIOCRUZ, o número de óbitos anual registrado devido à doença de Chagas é de aproximadamente 5 mil. É provável que esse número esteja subestimado, devido à precariedade do sistema de notificação da doença de Chagas no Brasil. A DALY (Disalibility-Adjusted Life Years) é uma medida que reflete o impacto agregado de uma dada enfermidade e quantifica as perdas advindas de mortes prematuras e agravos à saúde que não levaram à morte. Atualmente, estimam-se 700 mil DALYs e aproximadamente 100 milhões de indivíduos vivendo em áreas sob risco de contaminação (NWAKA, 2003; KETLER, 2004).
Pacientes com cardiopatia avançada estão sob maior risco de morte súbita elétrica. Infelizmente, esse evento não se restringe a um grupo de maior risco, acometendo também pacientes com função sistólica preservada e, em número absolutos, supera a mortalidade encontrada nos pacientes com disfunção miocárdica, na medida em que os pacientes sem disfunção constituem a grande maioria da população chagásica crônica. A despeito desses fatos, ainda não existe um consenso quanto à melhor estratégia para estratificação de risco nesse grupo de pacientes com cardiopatia chagásica crônica com função sistólica preservada.
A morte súbita (MS) arrítmica é a principal causa de óbito e pode ser a primeira manifestação da doença ou seu evento terminal (XAVIER, 2005, 2007). A morte súbita é responsável por 55-65% dos óbitos e pode ocorrer em qualquer fase da doença (RASSI, 2001). Em estudo realizado por Betestti e colaboradores, 20% dos pacientes com morte súbita eram assintomáticos, muitos dos quais com ECG normal (2008).
Experimentalmente, observa-se o surgimento de evidências que reforçam a hipótese fisiopatológica de que a perda da modulação parassimpática cardíaca esteja implicada em mecanismos de morte súbita elétrica na doença de Chagas. Oliveira e cols (1997) e Pedrosa (1998) mostraram que anticorpos provenientes de pacientes com cardiopatia chagásica crônica que possuíam arritmias ventriculares complexas eram capazes de diminuir a freqüência cardíaca e provocar bloqueio atrioventricular no coração isolado de coelho. Posteriormente, esse mesmo grupo descreveu que alguns destes pacientes possuíam anticorpos com efeito beta adrenérgico promovendo bloqueio da condução elétrica através de junções comunicantes na cultura de cardiomiócitos de ratos neonatos, sugerindo mais um mecanismo pelo qual esses anticorpos poderiam contribuir para a ocorrência de arritmias cardíacas (COSTA e cols, 2000).
Mais recentemente, Medei e cols demonstraram, pela primeira vez, que pacientes com cardiopatia chagásica crônica possuidores de anticorpos muscarínicos apresentavam maior dispersão do intervalo QT quando comparados a pacientes com cardiopatia chagásica crônica crônicos sem esse tipo de anticorpo. Esses mesmos anticorpos com efeito muscarínico, quando perfundidos no coração isolado de coelho, sob freqüência controlada, incrementavam o intervalo QT (2007). Desta forma, foi possível inferir que o comprometimento da repolarização ventricular poderia ser mediado por estes anticorpos e estar associado à instabilidade elétrica ventricular e, consequentemente, à morte súbita – uma das principais causas de óbito nos pacientes com cardiopatia chagásica crônica, conforme demonstrado por Salles (2003).
FISIOPATOLOGIA DA DOENÇA DE CHAGAS – CONSIDERAÇÕES GERAIS
A forma indeterminada faz parte da fase crônica da doença de Chagas e é a forma da doença mais encontrada em estudos populacionais em zona endêmica (DIAS, 2007). Após quatro a dez semanas da infecção, inicia-se a forma indeterminada da fase crônica, caracterizada pela positividade sorológica e/ou parasitológica, ausência de manifestações clínicas, eletrocardiográficas ou radiológicas significativas. Enquanto alguns pacientes permanecem nessa forma indefinidamente, outros, geralmente após intervalo de 20 a 30 anos, evoluem para alguma das formas crônicas determinadas da doença, com surgimento de evidências de comprometimento cardíaco, digestivo ou neurológico (DIAS, 1982).
O conhecimento sobre a forma indeterminada da fase crônica evoluiu com o próprio progresso dos métodos de investigação em cardiologia. Em protocolos de estudo, independente do método usado, seja invasivo ou não-invasivo, anormalidades, na maioria das vezes discretas, são encontradas em um número considerável desses pacientes.
Em relação ao comprometimento anatomopatológico na forma indeterminada da fase crônica, as alterações encontradas podem ser observadas em outras fases da doença, porém em percentuais diferentes. A hipertrofia, a degeneração de fibras, a fibrose e o infiltrado inflamatório são menos freqüentes nos pacientes com a forma indeterminada (CARRASCO, 1983).
A história natural da cardiopatia chagásica começa quando a destruição de fibras miocárdicas pelo processo inflamatório e a sua substituição por tecido fibroso atinge um limite crítico, obrigando os ventrículos a remodelarem-se frente à perda gradativa dos elementos contráteis. Uma inflamação crônica ativa, progressiva e fibrosante é o substrato morfológico fundamental dos mecanismos patogênicos responsáveis pela miocardite (MARIN-NETO e cols, 2007).
Os três folhetos cardíacos e o sistema de condução ficam comprometidos na doença de Chagas, e inúmeros achados experimentais e “in vivo” sugerem o envolvimento de linfócitos T na formação da lesão chagásica, associado à presença do parasita e/ou seus antígenos.
O remodelamento ventricular ocorre de duas maneiras: inicialmente, ocorre hipertrofia das fibras íntegras e, posteriormente, dilatação da cavidade ventricular. Essa hipertrofia extrínseca restaura temporariamente o volume sistólico já comprometido, mas a dinâmica do processo leva à dilatação cardíaca crescente, com perda progressiva da capacidade de ejeção ventricular em virtude da evolução da miocardite e da sobrecarga mecânica. Nos estágios mais avançados, além do componente sistólico, também se intensifica um componente de restrição diastólica, devido à grande dilatação e enrijecimento cardíacos pela fibrose. Contribuem ainda para o agravamento da cardiopatia, as arritmias ventriculares complexas, o tromboembolismo pulmonar repetido e a insuficiência das válvulas mitral e tricúspide(MARIN-NETO e cols, 2007).
Assim, na forma indeterminada da fase crônica podem-se detectar anormalidades contráteis discretas e, no que tange à função, as alterações diastólicas acabam precedendo as sistólicas (COMBELLAS e cols, 1985).
Para explicar a destruição de cardiomiócitos e a fibrose progressiva, quatro teorias principais encontraram suporte anátomo-patológico em pacientes e em modelos experimentais (MARIN-NETO e cols, 2007):
(1) destruição direta pelo T.cruzi;
(2) teoria neurogênica, com destruição de células ganglionares e lesões do sistema de condução;
(3) reações auto-imunes cardíacas (humorais e/ou celulares);
(4) comprometimento microvascular (microespasmos, microtrombos, disfunção de células endoteliais e aumento de atividade plaquetária).
Desta forma, o desenvolvimento da miocardite dependeria de processos focais de necrose celular, sucessivos e progressivos, levando a uma fibrose miocárdica reativa e reparativa, com hipertrofia de cardiomiócitos adjacentes. Essa necrose poderia ser iniciada e perpetuada por fatores imunes e/ou alterações isquêmicas da microcirculação (MARIN-NETO e cols, 2007).
Outro fato que vem chamando à atenção dos pesquisadores, é que a progressão da severidade da cardiopatia chagásica está associada ao aumento no dano oxidativo particularmente às proteínas, lipídios cardíacos e, secundariamente, às mitocôndrias (WEN, 2004; OLIVEIRA, 2007). Vários estudos têm sugerido que alterações na atividade da cadeia respiratória mitocondrial, principalmente complexo I (NADH-ubiquitona oxiredutase) e III (Ubiquinol-citocromo c redutase), estejam relacionadas com a geração de espécies reativas de oxigênio (ERO) e espécies reativas de nitrogênio (ERN) no coração de pacientes chagásicos, contribuindo para o dano oxidativo (WEN, 2004; OLIVEIRA, 2007)
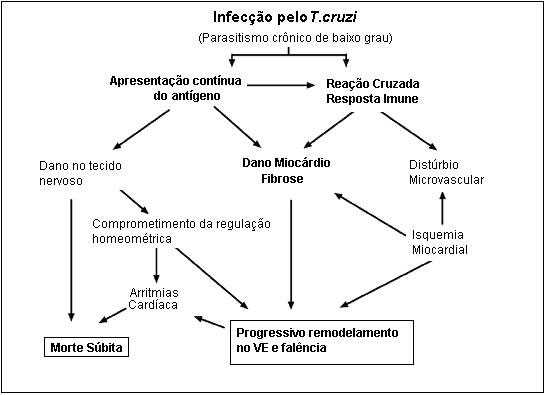
Figura 1: Patogênese da cardiopatia chagásica crônica. Os dois principais mecanismos de lesão: persistência do parasito e a resposta imunológica que causam lesão miocárdica e fibrose com remodelamento progressivo e falência. Sigla: VE, ventrículo esquerdo. (Fonte: BIOLO, 2010).
A ativação de células T consiste o tipo predominante de células em lesões inflamatórias da cardiopatia chagásica crônica (REIS, 1993). Além disso, a presença de citocinas pré e pró-inflamatórias (IL-4, IL-6, IL-12, TNF, IFN) tem sido encontrada no sangue periférico de pacientes com a forma indeterminada e na forma cardíaca da doença de Chagas, induzidas pela membrana lipídica do T. cruzi (DUTRA,1997).
Um número significativo de estudos disponíveis na literatura apoia a hipótese de que a resposta imune amplificada pelo processo inflamatório e desencadeada de forma consistente seja pela persistência do parasito ou pela resposta do hospedeiro aos auto-antígenos, desempenhe um papel no desenvolvimento e progressão na cardiopatia chagásica crônica (ZACKS, 2005; BIOLO, 2010).
TEORIA NEUROGÊNICA
Os adeptos desta idéia se baseiam em vários fatores:
1) escassez de parasitas nas lesões cardíacas da doença de Chagas, ou sua desproporção com o grau de inflamação tecidual, mesmo utilizando-se técnicas mais sensíveis, como o PCR ou a imunohistoquímica;
2) período latente prolongado, entre o fim da fase aguda até o surgimento da forma crônica cardíaca;
3) evidências da existência de uma quebra da tolerância imunológica;
4) o fato de que, embora o T. cruzi seja capaz de invadir vários órgãos (como células adrenais, uterinas, da bexiga, esôfago e outras) causando uma infiltração mononuclear focal ou nenhuma reação, no coração ele leva a uma severa e destrutiva miocardite;
5) quadro clínico-patológico diferente entre os pacientes;
6) existência de anticorpos circulantes e ligados ao miocárdio e infiltração miocárdica por células linfomononucleares, além de anormalidades nas subpopulações de linfócitos na doença de Chagas e
7) associação entre a presença de anticorpos que reconhecem estruturas do hospedeiro, a ocorrência de disfunção autonômica e a pior evolução clínica da doença de Chagas. Deste modo, a reação auto-imune é postulada como um dos fatores principais na patogênese da disautonomia na doença de Chagas.
Estudos patológicos em humanos e análises experimentais em modelos animais de infecção chagásica evidenciam depopulação neuronal marcante nos vários estágios evolutivos da doença (JUNQUEIRA, 2006).
Dentre os aspectos histopatológicos mais marcantes, encontra-se a destruição neuronal difusa e irregularmente distribuída nos vários tecidos. Observa-se parasitismo ganglionar direto, assim como periganglionite e lesões degenerativas das fibras nervosas e das células de Schwann. Embora mais estudadas no que se refere ao sistema parassimpático intramural cardíaco, essas anormalidades também envolvem o sistema ganglionar simpático paravertebral (ALCÂNTARA, 1970).
Em correspondência a esses estudos histopatológicos, extensa gama de investigações clínicas documentou, em humanos, graus intensos de depressão do controle autonômico cardíaco, predominante, mas não exclusivamente, parassimpático (AMORIM e MARIN-NETO, 1995).
Na forma indeterminada, observações usando diferentes testes, incluindo testes com análise de variabilidade de freqüência cardíaca, mostram comprometimento variável da modulação parassimpática e simpática. Alguns autores mostraram disfunção autonômica vagal variável, enquanto outros mostram menor distúrbio vagal (VASCONCELOS e cols, 2009).
Investigações mais recentes, utilizando a cintilografia com 123I-MIBG , possibilitaram a avaliação direta do sistema simpático do miocárdio. Denervação simpática regional foi verificada em áreas sem anormalidades contráteis em elevado percentual de pacientes, e constituiu a primeira evidência de distúrbio do sistema simpático ventricular na cardiopatia chagásica crônica (SIMÕES e cols, 2000).
Em recente tese de doutorado, a cintilografia com 123I-MIBG foi utilizada em 40 pacientes com cardiopatia chagásica crônica com função sistólica preservada (FE > 45%), tendo mostrado que 95% dos pacientes com cardiopatia chagásica crônica tiveram a relação coração/mediastino (C/M) de 3h < 2,19. Dentre os com cardiopatia chagásica crônica com C/M de 3 h < 2,19, 65,7% tiveram ECG limítrofe e 56% destes tiveram C/M 3h < 1,8. Os dados deste estudo sugerem uma significativa prevalência de alterações da inervação simpática cardíaca no grupo de pacientes com ECG alterado (LANDESMAN, 2011).
Ambos os estudos observaram altas taxas de dissipação da impregnação miocárdica com 123I-MIBG em regiões ventriculares, exibindo mobilidade normal. Tal alteração poderia ser decorrente de aumento precoce da atividade simpática miocárdica, e interpretada como elemento compatível com os postulados da teoria neurogênica. Entretanto, explicação alternativa consiste na possibilidade de ocorrência de competição pelos receptores neurais simpáticos, entre o radiotraçador utilizado e as substâncias endógenas antagônicas.
O déposito de anticorpos em estruturas de receptores neurotransmissores poderia causar sua dessensibilização, acarretando denervação progressiva. Mecanismos como estes, se comprovados em investigações adicionais, poderiam conciliar alterações neurogênicas e agressão imunológica como fatores fisiopatológicos interativos e relevantes envolvidos em mecanismos de arritmias cardíacas complexas na doença de Chagas (MEDEI, 2008).
PAPEL ELETROFISIOLÓGICO DO ANTICORPOS FUNCIONALMNTE ATIVOS COM REATIVIDADE CONTRA RECEPTORES CARDÍACOS ENVOLVIDOS NA GÊNESE DAS ARRITMIAS CARDÍACAS
Uns dos primeiros trabalhos a propor que um componente humoral poderia estar envolvido na gênese das arritmias na cardiomiopatía chagásica foi publicado por De Carvalho e cols. (1994). Nessa oportunidade, descreveram que soros provenientes de coelhos infectados com T cruzi geravam distúrbios eletrocardiográficos no coração isolado de coelho. Três anos após, confirmou-se essa hipótese mostrando que anticorpos provenientes de pacientes com cardiopatia chagásica crônica que possuíam arritmias complexas diminuíam a freqüência cardíaca e provocaram bloqueio atrioventricular no coração isolado de coelho (OLIVEIRA e cols, 1997; PEDROSA, 1998). Em seguida, com número maior de pacientes, esse mesmo grupo descreveu que alguns deles apresentavam efeito beta adrenérgico bloqueando a condução através de junções comunicantes em cultura de cardiomiócitos de ratos neonatos sugerindo, assim, mais um mecanismo pelo quais estes anticorpos poderiam contribuir para a ocorrência de arritmias ventriculares (COSTA e cols, 2000).
Outro trabalho que sustenta o papel arritmogênico dos anticorpos foi publicado por Kaplan e cols. (1997), no qual foram imunizados coelhos com o peptídeo da segunda alça extracelular do receptor beta-adrenérgico, mostrando pós-potenciais precoces e uma diminuição na densidade das correntes de potássio das células M desses animais.
Já o grupo de Mauricio Rosenbaum (1994) mostrou a presença dos anticorpos em pacientes com cardiopatia chagásica crônica e o possível envolvimento dos mesmos nas arritmias desses pacientes. Este grupo demostrou uma correlação entre determinados distúrbios de condução e a resposta das IgGs presentes no soro dos pacientes com cardiopatia chagásica crônica. De fato, as IgGs dos pacientes que possuíam arritmias ventriculares incrementaram a freqüência de batimentos e a produção de AMPc (75%), enquanto que as IgGs dos pacientes portadores de disfunção do nodo sinusal diminuíram a freqüência de batimentos e incrementaram a síntese de fosfatidilinositol (76.9%), em cultura de cardiomiócitos de ratos (CHIALE, 1995).
Até 2007, todos os trabalhos relacionaram o papel dos anticorpos com distúrbios de condução, focalizando principalmente na disfunção da condução atrioventricular sem considerar o comprometimento da repolarização ventricular que poderia ser mediado por estes anticorpos e estar relacionado a indução de morte súbita, que é uma das principais causas de morte nos pacientes com cardiopatia chagásica crônica. Conforme mencionado anteriormente, anticorpos com efeito muscarínico também se mostraram envolvidos na promoção de maior dispersão do intervalo QT, possível envento deflagrador de arritmia (MEDEI, 2007).
Dada a magnitude do problema e os resultados modestos na redução de morte súbita neste grupo de pacientes com os métodos modernos de tratamento, de alto custo, há necessidade de se identificar o paciente de risco e de se delinear o processo que iniciou ou facilitou estas arritmias, para que o mesmo seja mais efetivamente tratado.
RELAÇÃO ENTRE DISFUNÇÃO AUTONÔMICA E ANTICORPOS FUNCIONALMENTE ATIVOS COM REATIVIDADE CONTRA RECEPTORES CARDÍACOS
A este respeito, vários pontos permanecem sem resposta, como:
1) o papel exato destes anticorpos na lesão do sistema nervoso autônomo da doença de Chagas;
2) se os seus efeitos se repetem em tecido humano;
3) o motivo do contraste entre o curto tempo (desde a infecção aguda) até o surgimento dos anticorpos e o longo tempo até o aparecimento das lesões patológicas;
4) a explicação para o fato de estes anticorpos serem encontrados também em pacientes assintomáticos;
5) o porque destes anticorpos serem capazes de produzir efeitos tão deletérios in vitro, mas não causar os mesmos danos em muitos dos pacientes dos quais foram obtidos;
6) a explicação de porque estes anticorpos provocariam o típico infiltrado mononuclear – visto na doença de Chagas, ao invés do infiltrado predominantemente granulocítico, que se segue à deposição de imunoglobulinas (KIERSZENBAUM, 2003).
Entretanto, se é difícil provar que a autoimunidade, vinculada ao mimetismo antigênico e à reatividade cruzada, é a causa definitiva da disfunção autonômica na doença de Chagas, ainda mais difícil, se não impossível, é provar que ela não está envolvida neste processo, gerando controvérsias na literatura até os dias de hoje.
Embora o mecanismo da disfunção autonômica na fase crônica da doença de Chagas ainda não tenha sido esclarecido, relatos recentes sobre a existência de anticorpos circulantes, com capacidade de ligação a receptores tanto colinérgicos (Ac-M) como adrenérgicos (Ac-β), poderiam conciliar as alterações neurogênicas e a agressão imunológica como fatores fisiopatológicos interativos e relevantes.
Assim, Goin e cols. (1994) mostraram associação entre anticorpos circulantes (IgG), com capacidade de ligação a receptores tanto colinérgicos como adrenérgicos, e alterações autonômicas. A presença de anticorpos funcionalmente ativos com reatividade contra receptores muscarínicos colinérgicos em pacientes com cardiopatia chagásica crônica com graus diferentes de comprometimento cardíaco foi relatada pela primeira vez por Oliveira e cols. (1997) e Pedrosa e cols. (1998). Ambos mostraram que a presença dos anticorpos funcionantes independe do grau de comprometimento cardíaco. Desta forma, esse grupo de pacientes demanda maiores estudos, particularmente no que se refere à relação entre disfunção autonômica e anticorpos funcionantes circulantes (IgG), com capacidade de ligação a receptores tanto colinérgicos como adrenérgicos. Mais recentemente, Talvani e cols. (2006) mostraram essa mesma associação de forma independente da disfunção ventricular, porém com limitação maior no que tange à funcionalidade dos anticorpos.
CLASSIFICAÇÃO CLÍNICA
As manifestações cardíacas geralmente se iniciam com alterações no sistema de condução, mais frequentemente com bloqueio do ramo direito ou bloqueio fascicular anterior e anormalidades vasculares do segmento ventricular esquerdo. Posteriormente, manifestações tardias incluem extrassístoles ventriculares e taquicardia ventriculares, disfunção e/ou doença do nodo sino atrial, alto grau de bloqueio cardíaco, fenômenos tromboembólicos, cardiomiopatia em fase dilatada com insuficiência cardíaca congestiva (BERN, 2007). Essas anormalidades desencadeiam palpitações, lipotímia, sincope e alto risco de morte súbita. Em vista deste polimorfismo clínico, vários sistemas de classificação são utilizados na América Latina para facilitar o manejo clínico desses pacientes, bem como para a avaliação prognóstica e terapêutica; os mais importantes discriminam alterações no eletrocardiograma (ECG) e presença ou ausência de insuficiência cardíaca congestiva. A classificação adotada na presente revisão é a Classificação de Los Andes modificada por Xavier (XAVIER, 1999).
Essa classificação define estágios evolutivos de acometimento cardíaco na doença de Chagas, baseado na análise clínica, eletrocardiográfica e ecocardiográfica, conforme segue:
Grupo I:
Pacientes com sorologia positiva, assintomáticos e sem evidências clínicas, eletrocardiográficas ou radiológicas de cardiopatia. De acordo com os achados do ecocardiograma (ventriculograma) estes pacientes foram subdividos por sua vez nos subgrupos IA e IB. No subgrupo IA se agrupavam os pacientes com ventriculograma normal, classificados como casos de “infecção chagásica sem lesões cardíacas”. No subgrupo IB foram incluídos aqueles chagásicos com evidências de acinesia em um ou mais segmentos do ventrículo esquerdo (usualmente no ápice e região ínfero-lateral esquerda). Estes pacientes foram classificados como portadores de cardiopatia crônica na fase inicial.
Grupo II:
Pacientes com sorologia positiva, assintomático ou não, com anormalidades no ECG convencional de repouso. Estas foram usualmente extra-sístoles ventriculares e/ou distúrbios na condução AV ou intraventriculares, excetuando os bloqueios incompletos do ramo direito e esquerdo, bloqueio AV de 1° grau e as alterações inespecíficas da repolarização ventricular. Este grupo foi classificado como “chagásicos com o ECG anormal e sem insuficiência cardíaca”.
Grupo III:
Pacientes com sorologia positiva e evidência passada ou presente de insuficiência cardíaca congestiva, classificados como “em fase de insuficiência miocárdica”.
MORTE SÚBITA NA DOENÇA DE CHAGAS
A morte súbita é o mais expressivo fenômeno da história natural da doença de Chagas, afetando indivíduos na fase mais produtiva de suas vidas, geralmente entre os 30 e 50 anos de idade (RASSI JR. e MARIN-NETO, 2000). Ocorre, geralmente, durante as atividades físicas rotineiras, esforço físico ou estresse emocional e, em cerca de metade dos casos, ocorre espontaneamente. A outra metade é precedida por sintomas durante alguns segundos ou, raramente, minutos. Ela ocorre nos chagásicos aparentemente saudáveis sem nenhum conhecimento ou indício sintomático de doença cardíaca.
Este trágico desfecho chamou a atenção do pesquisador Carlos Chagas já no início de suas descobertas clínicas quando ele relatou: “… Em regiões onde a doença é comum, o número de indivíduos adultos com desordens cardíacas profundas é expressivo… a conseqüência imediata deste fato é o grande número de mortes rápidas causadas pela doença, e é realmente expressivo na estatística de letalidade o grande número de pessoas que morrem subitamente devido à síncope cardíaca”. Posteriormente, o pesquisador ainda comenta que muitas famílias foram surpreendidas com a morte súbita de um ou mais membros, que morreram jovens e com saúde aparentemente boa (CHAGAS e VILLELA, 1922).
Baseando-se em dados de vários estudos e considerando-se os diferentes estágios evolutivos da doença constatou-se que a morte súbita é responsável por 55% a 65% das mortes na doença de Chagas – frequentemente fibrilação ventricular e, menos comumente, assistolia; seguida da insuficiência cardíaca (25% a 30%) e fenômenos tromboembólicos (10% a 15%). Em geral, considerando todos os estágios evolutivos da doença, podemos dizer que a morte súbita é a maior causa de morte nesta doença (RASSI JR. e cols, 2001).
Apesar da alta prevalência da doença de Chagas no Brasil e América Latina, não existem estudos anatomopatológicos sistematizados em pacientes com cardiopatia chagásica crônica com morte súbita na literatura. Qualitativamente, as lesões cardíacas encontradas no paciente cuja morte súbita ocorreu de forma inesperada são semelhantes àquelas encontradas em pacientes que morreram após longo período de insuficiência cardíaca. Entretanto, quantitativamente essas alterações são mais discretas nos corações dos pacientes com morte súbita inesperada (LOPES e cols, 1975).
O risco de morte súbita não é obviamente o mesmo em todo paciente com cardiopatia chagásica crônica, motivo pelo qual vários autores têm tentado identificar fatores que predispõe certos pacientes a um alto risco deste evento catastrófico (RASSI e cols, 2006; ESPINOSA e cols, 1985; CARDINALLI-NETO e cols, 2007; BESTETTI e cols, 1996).
Em 1973, iniciou-se no nordeste brasileiro estudo longitudinal de campo em área rural endêmica. Nos indivíduos com cardiopatia chagásica crônica sem cardiopatia clinicamente aparente o desenvolvimento de anormalidades no ECG ocorreu em uma taxa anual de 2,5%, contra 1,2% dos indivíduos sorologicamente negativos, configurando risco relativo igual a 2,0 para mortalidade. O que chama a atenção neste trabalho é que a mortalidade anual foi nitidamente associada à presença de arritmias ventriculares (MOTA e cols, 1990).
Existem cerca de três milhões de pacientes na forma indeterminada no Brasil, além de um número adicional significativo de pacientes com cardiopatia silenciosa e assintomáticos (DIAS, 2007). Se for considerada a incidência de morte súbita como de 0,04‰ ao ano, conforme encontrada entre chagásicos sem alterações cardíacas no estudo longitudinal de Buenos Aires, pode-se esperar em torno de 120 óbitos ao ano, na numerosa população brasileira de chagásicos com função sistólica preservada e eletrocardiograma normal ou alterado (MANZULLO e cols, 1982).
De acordo com estatísticas não oficiais, em torno de 50.000 mortes por doença de Chagas ocorrem a cada ano, sendo um total de 60% súbitas. Considerando-se que 16 a 18 milhões de indivíduos com cardiopatia chagásica crônica existem na América Latina, a taxa anual de morte súbita pode ser estimada em 0,17% a 0,19% (aproximadamente 2/1000). Estas cifras não são suficientemente expressivas para justificar uma estratégia de prevenção indiscriminada. Portanto, é fundamental estabelecer de forma adequada subgrupos de maior risco de morte súbita para que essas estratégias de prevenção sejam custo-efetivo..
Assim, podemos postular que a morte súbita elétrica é uma complicação rara de uma condição comum – chagásicos com função sistólica preservada e eletrocardiograma normal ou alterado, e esta é a forma da doença mais encontrada em estudos populacionais em zona endêmica (MARIN-NETO e cols, 1999). A mutabilidade eletrocardiográfica é uma importante característica deste grupo (PEDROSA, 1993).
DISFUNÇÃO AUTONÔMICA E MORTE SÚBITA NA DOENÇA DE CHAGAS CRÔNICA
O estudo do acometimento autonômico cardíaco na doença de Chagas poderia ser uma questão meramente acadêmica, caso não fossem importantes suas implicações fisiopatológicas. Postula-se que a disfunção autonômica possa participar de diversos processos importantes na doença de Chagas, como a morte súbita e as arritmias cardíacas (RASSI JR e cols, 2001; JUNQUEIRA Jr, 2006). A relação entre a disfunção autonômica e a morte súbita cardíaca tem sido estudada principalmente em pacientes pós-infarto agudo do miocárdio, nos quais se detectam alterações pronunciadas do controle autonômico, que se manifestam geralmente por redução do controle cardíaco parassimpático e predominância simpática (MALIK, 1990).
Na doença de Chagas, postula-se um possível papel da disfunção autonômica vagal na gênese da morte súbita. Figueiredo e cols (1996) mostraram a ação protetora vagal nos pacientes cardiopatas chagásicos crônicos, com arritmias ventriculares complexas bem toleradas hemodinamicamente.
Segundo alguns autores, ainda que não constitua mecanismo lesivo primário e independente, a intensa redução da população neuronal cardíaca nos vários estágios evolutivos da doença pode contribuir como mecanismo secundário e amplificador da lesão produzida pelo parasita no sistema nervoso autônomo (MARIN-NETO e cols, 2007).
A relação entre disfunção autonômica e morte súbita foi prevista no modelo biológico de Myerburg para a ocorrência de fibrilação ventricular (MYERBURG e cols, 1989). Neste trabalho, o autor ressalta a necessidade de três fatores para a instalação da arritmia: o substrato arritmogênico, os eventos deflagadores e as alterações funcionais; é neste último item que se contextualiza a relevância do desequilíbrio vago-simpático.
No paciente chagásico, é possível identificar claramente os três fatores de Myerburg: o substrato arritmogênico seria representado pelas zonas fibróticas e inflamatórias do miocárdio, os eventos deflagadores pelas extassístoles ventriculares tão presentes, e as alterações funcionais pela presença de disfunção simpática e parassimpática. Porém, nem todos os portadores de arritmias ventriculares complexas apresentam morte súbita e desse fato conclui-se que as alterações funcionais existentes na doença de Chagas – tais como alterações autonômicas, desordens eletrolíticas, alterações hemodinâmicas, hipoxemia, acidose, drogas anti-arrítmicas e tônus simpático basalmente aumentado, podem ser fatores desestabilizadores do miocárdio, representando assim a chave para a compreensão da morte súbita na cardiopatia chagásica crônica.
Sabe-se que a disfunção parassimpática é um dos fatores chave na morte súbita cardíaca, através da perda de sua proteção miocárdica estabilizadora e anti-arritmogênica. Baroldi e cols (1997), estudando o coração de 34 pacientes chagásicos que faleceram subitamente, observaram dano miocárdico típico da cardiotoxicidade catecolaminérgica. Nestes sítios, encontraram ainda alterações histológicas compatíveis com depopulação neuronal simpática, que seria à primeira vista um achado paradoxal. A hipótese postulada por estes pesquisadores para explicar tal paradoxo seria que a destruição dos neurônios simpáticos regionais levaria a um aumento da secreção de neurotransmissores adrenérgicos que, por sua vez, causaria a toxicidade miocárdica encontrada.
A severidade da denervação simpática e parassimpática foi observada por Machado e cols. (2000), comparando por técnicas de imunohistoquímica o coração de pacientes chagásicos com aqueles cardiopatas de outras etiologias. Neste trabalho, concluiu-se que o coração do chagásico distingue-se dos demais pacientes pela maior quantidade de inflamação e pela severidade e precocidade de denervação autonômica, principalmente parassimpática.
O grupo de pesquisadores do HUCFF/UFRJ constatou que pacientes chagásicos crônicos com disfunção miocárdica severa possuem excreção urinária de noradrenalina muito inferior (p<0,0001) a pacientes cardiopatas de outras etiologias com níveis semelhantes de dano miocárdico, o que corrobora a tese de significativa disfunção simpática pelo menos em fases avançadas da doença. Neste mesmo trabalho, observou-se a redução dos índices parassimpático no domínio de tempo, através do Holter de 24 horas, em estágios iniciais da doença, caracterizando dano parassimpático precoce (CUNHA, 2003).
Esse mesmo grupo estabeleceu, posteriormente, em pacientes chagásicos crônicos, a relação entre a presença de anticorpos agonistas contra receptores muscarínicos e a disfunção do nódulo sinusal independente do comprometimento cardíaco, idade e clínica de insuficiência cardíaca. Sabe-se, também, que a disfunção do nódulo sinusal é um preditor de morte súbita na doença de Chagas (ALTSCHULLER e cols, 2007).
REFERÊNCIAS
ALCANTARA, F. G. [Cytological differences between the neurons of the sympathetic and parasympathetic nervous system]. Hospital (Rio J), v. 78, n. 4, p. 1157-61, Oct 1970.
ALTSCHULLER, M. B. et al. [Chronic Chagas disease patients with sinus node dysfunction: is the presence of IgG antibodies with muscarinic agonist action independent of left ventricular dysfunction?]. Rev Soc Bras Med Trop, v. 40, n. 6, p. 665-71, 2007 Nov-Dec 2007.
AMORIM, D. D.; MARIN NETO, J. A. Functional alterations of the autonomic nervous system in Chagas’ heart disease. São Paulo Med J, v. 113, n. 2, p. 772-84, 1995 Mar-Apr 1995.
ANDRADE, J. P. et al. Sociedade Brasileira de Cardiologia. I Diretriz Latino Americana para o Diagnóstico e Tratamento da Cardiopatia Chagásica. Arq Bras Cardiol, v. 97, n. 2 (supl.3), p. 1-47, 2011.
BAROLDI, G.; OLIVEIRA, S. J.; SILVER, M. D. Sudden and unexpected death in clinically ‘silent’ Chagas’ disease. A hypothesis. Int J Cardiol, v. 58, n. 3, p. 263-8, Feb 1997.
BERN, C.; MONTGOMERY, S. P.; HERWALDT, B. L.; et al. Evaluation and treatment of Chagas disease in the United States: A Systematic Review. JAMA. v. 298, p. 2171-2181, 2007.
BESTETTI, R. B. et al. Predictors of sudden cardiac death for patients with Chagas’ disease: a hospital-derived cohort study. Cardiology, v. 87, n. 6, p. 481-7, 1996 Nov-Dec 1996.
BESTETTI, R. B.; CARDINALLI-NETO, A. Sudden cardiac death in Chagas’ heart disease in the contemporary era. Int J Cardiol, v. 131, n. 1, p. 9-17, Dec 2008.
BIOLO, A.; RIBEIRO, A. L.; CLAUSELL, N. Chagas cardiomyopathy – where do we stand after a hundred years? Prog Cardiovasc Dis. 2010.
CARDINALLI-NETO, A. et al. Predictors of all-cause mortality for patients with chronic Chagas’ heart disease receiving implantable cardioverter defibrillator therapy. J Cardiovasc Electrophysiol, v. 18, n. 12, p. 1236-40, Dec 2007.
CARRASCO-GUERRA, H. A. Diagnostico de dano miocardico en la Enfermedad de Chagas. Mérida: Consejo de Publicaciones de la Universidad de Los Andes, 1983.
CHAGAS, C. e VILLELA, E. Forma Cardíaca da Typanosomíase Américana. Memórias do Instituto Osvaldo Cruz, v.14, p. 5-61, 1922.
CHIALE, P. A. et al. High prevalence of antibodies against beta 1- and beta 2-adrenoceptors in patients with primary electrical cardiac abnormalities. J Am Coll Cardiol, v. 26, n. 4, p. 864-9, Oct 1995.
COMBELLAS, I. et al. Echocardiographic features of impaired left ventricular diastolic function in Chagas’s heart disease. Br Heart J, v. 53, n. 3, p. 298-309, Mar 1985.
CONSENSO Brasileiro de Doença de Chagas. Rev Soc Bras Med Trop, v. 38, suppl. III, p. 1-29, 2005.
COSTA, P. C. et al. Sera from chronic chagasic patients depress cardiac electrogenesis and conduction. Braz J Med Biol Res, v. 33, n. 4, p. 439-46, Apr 2000.
CUNHA, A. B. et al. Norepinephrine and heart rate variability: a marker of dysautonomia in chronic Chagas cardiopathy. Rev Port Cardiol, v. 22, n. 1, p. 29-52, Jan 2003.
DIAS, J. C. P. Doença de Chagas em Bambui MG Brasil. Estudo clínico-epidemiológico a partir da fase aguda entre 1940 e 1982. Tese de doutorado, Faculdade de medicina, UFMG, Belo Horizonte, 1982.
DIAS, J. C. [Globalization, inequity and Chagas disease]. Cad Saude Publica, v. 23 Suppl 1, p. S13-22, 2007a.
ENGELS, D.; SAVIOLI, L. Reconsidering the underestimated burden caused by neglected tropical diseases. Trends Parasitol, v. 22, n. 8, p. 363-6, Aug 2006.
ESPINOSA, R. et al. Life expectancy analysis in patients with Chagas’ disease: prognosis after one decade (1973-1983). Int J Cardiol, v. 8, n. 1, p. 45-56, May 1985.
FIGUEIREDO, E. et al. Variabilidade da freqüência cardíaca como preditor de taquicardia ventricular sustentada e morte súbita na cardiopatia chagásica. Arquivos Brasileiros de Cardiologia, 67:150, 1996.
GELB, M. H.; HOL, W. G. Parasitology. Drugs to combat tropical protozoan parasites. Science, v. 297, n. 5580, p. 343-4, Jul 2002.
GOIN, J. C. et al. Identification of antibodies with muscarinic cholinergic activity in human Chagas’ disease: pathological implications. J Auton Nerv Syst, v. 47, n. 1-2, p. 45-52, Apr 1994a.
JUNQUEIRA, L. F. A summary perspective on the clinical-functional significance of cardiac autonomic dysfunction in Chagas’ disease. Rev Soc Bras Med Trop, v. 39 Suppl 3, p. 64-9, 2006.
KAPLAN, D. et al. Antibodies to ribosomal P proteins of Trypanosoma cruzi in Chagas disease possess functional autoreactivity with heart tissue and differ from anti-P autoantibodies in lupus. Proc Natl Acad Sci U S A, v. 94, n. 19, p. 10301-6, Sep 1997.
KETTLER, H. E.; MARJANOVIC, S. Engaging biotechnology companies in the development of innovative solutions for diseases of poverty. Nat Rev Drug Discov, v. 3, n. 2, p. 171-6, Feb 2004.
KIERSZENBAUM, F. Views on the autoimmunity hypothesis for Chagas disease pathogenesis. FEMS Immunol Med Microbiol, v. 37, n. 1, p. 1-11, Jun 2003.
LANDESMANN, M. C. et al. Iodine-123 metaiodobenzylguanidine cardiac imaging as a method to detect early sympathetic neuronal dysfunction in chagasic patients with normal or borderline electrocardiogram and preserved ventricular function. Clin Nucl Med, v. 36, n. 9, p. 757-61, Sep 2011.
LOPES, M. G. et al. Comparison of 24 versus 12 hours of ambulatory ECG monitoring. Chest, v. 67, n. 3, p. 269-73, Mar 1975.
MACHADO, C. R. et al. Cardiac autonomic denervation in congestive heart failure: comparison of Chagas’ heart disease with other dilated cardiomyopathy. Hum Pathol, v. 31, n. 1, p. 3-10, Jan 2000.
MALIK, M.; FARRELL, T.; CAMM, A. J. Circadian rhythm of heart rate variability after acute myocardial infarction and its influence on the prognostic value of heart rate variability. Am J Cardiol, v. 66, n. 15, p. 1049-54, Nov 1990.
MANZULLO, E. C. et al. Estudio longitudinal de la cardiopatia chagasica cronica. Centro de Chagas de la Catedra de Enfermedades Infecciosas de la Facultad de Ciencias Medicas de Buenos Aires, 1982.
MARIN NETO, J. A.; SIMõES, M. V.; SARABANDA, A. V. Chagas’ heart disease. Arq Bras Cardiol, v. 72, n. 3, p. 247-80, Mar 1999.
MARIN-NETO, J. A. et al. Pathogenesis of chronic Chagas heart disease. Circulation, v. 115, n. 9, p. 1109-23, Mar 2007.
MEDEI, E. et al. Human antibodies with muscarinic activity modulate ventricular repolarization: basis for electrical disturbance. Int J Cardiol, v. 115, n. 3, p. 373-80, Feb 2007.
MEDEI, E. H. et al. Role of autoantibodies in the physiopathology of Chagas’ disease. Arq Bras Cardiol, v. 91, n. 4, p. 257-62, 281-6, Oct 2008.
MOTA, E. A. et al. A nine year prospective study of Chagas’ disease in a defined rural population in northeast Brazil. Am J Trop Med Hyg, v. 42, n. 5, p. 429-40, May 1990.
MYERBURG, R. J. et al. A biological approach to sudden cardiac death: structure, function and cause. Am J Cardiol, v. 63, n. 20, p. 1512-6, Jun 1989.
NWAK A, S.; RIDLEY, R. G. Virtual drug discovery and development for neglected diseases through public-private partnerships. Nat Rev Drug Discov, v. 2, n. 11, p. 919-28, Nov 2003.
OLIVEIRA, S. F. et al. Sera from chronic chagasic patients with complex cardiac arrhythmias depress electrogenesis and conduction in isolated rabbit hearts. Circulation, v. 96, n. 6, p. 2031-7, Sep 1997.
OLIVEIRA, T. B.; PEDROSA, R. C.; WILHELM-FILHO, D. Oxidative stress in chronic cardiopathy associated with Chagas disease. Int J Cardiol. v. 116, n. 3, p.357-363, 2007.
PEDROSA, R. C.; CANçADO, J. R.; DECACHE, W. [A longitudinal electrocardiogram study of Chagas’ disease from the acute phase]. Rev Soc Bras Med Trop, v. 26, n. 3, p. 163-74, 1993 Jul-Sep 1993.
PEDROSA RC. Contribuição ao estudo da etiopatogenia do distúrbio de condução e da eletrogênese na cardiopatia chagásica crônica. Efeitos de anticorpos IgG de pacientes chagásicos crônicos na eletrogênese e no sistema de condução do coração isolado de mamíferos. Tese de Doutorado. Rio de Janeiro: Universidade Federal do Rio de Janeiro, 1998.
RASSI, A. Jr, MARIN-NETO JA. Cardiopatia chagásica crônica. Rev Soc Cardiol Est Sao Paulo, v. 4: p. 7-32, 2000.
RASSI, A.; RASSI, S. G. Sudden death in Chagas’ disease. Arq Bras Cardiol, v. 76, n. 1, p. 75-96, Jan 2001.
RASSI, A. et al. Development and validation of a risk score for predicting death in Chagas’ heart disease. N Engl J Med, v. 355, n. 8, p. 799-808, Aug 2006.
REIS, D.D. et al. Expression of major histocompatibility complex antigens and adhesion molecules in hearts of patients with chronic Chagas disease. Am J Trop Med Hyg, v. 49, p.192-199, 1993.
DUTRA, W. O. Cytokine mRNA profile of peripheral blood mononuclear cells isolated from individuals with Trypanosoma cruzi chronic infection. Scand J Immunol, v. 45, n. 1, p.74-80, 1997.
ROSENBAUM, M. B. et al. Antibodies to beta-adrenergic receptors disclosing agonist-like properties in idiopathic dilated cardiomyopathy and Chagas’ heart disease. J Cardiovasc Electrophysiol, v. 5, n. 4, p. 367-75, Apr 1994.
SALLES, G. et al. Prognostic value of QT interval parameters for mortality risk stratification in Chagas’ disease: results of a long-term follow-up study. Circulation, v. 108, n. 3, p. 305-12, Jul 2003.
SIMOES, M. V. et al. Relation of regional sympathetic denervation and myocardial perfusion disturbance to wall motion impairment in Chagas’ cardiomyopathy. Am J Cardiol, v. 86, n. 9, p. 975-81, Nov 2000.
STERNICK, E. B. et al. Sudden cardiac death in patients with chagas heart disease and preserved left ventricular function. J Cardiovasc Electrophysiol, v. 17, n. 1, p. 113-6, Jan 2006.
TALVANI, A. et al. Levels of anti-M2 and anti-beta1 autoantibodies do not correlate with the degree of heart dysfunction in Chagas’ heart disease. Microbes Infect, v. 8, n. 9-10, p. 2459-64, Aug 2006.
VASCONCELOS, D. F.; JUNQUEIRA, L. F. Distinctive impaired cardiac autonomic modulation of heart rate variability in chronic Chagas’ indeterminate and heart diseases. J Electrocardiol, v. 42, n. 3, p. 281-9, 2009 May-Jun 2009.
WEN, J.J.; VYATKINA, G.; GARG, N. Oxidative damage during chagasic cardiomyopathy development: Role of mito chondrial oxidant release and inefficient antioxidant defense. Free Radical Biology and Medicine. v. 37, p. 1821-1833, 2004.
XAVIER, S. S. Estudo longitudinal da morbi-mortalidade cardíaca da doença de Chagas em uma coorte de um grande centro urbano: análise clínica, eletrocardiográfica, radiológica e ecocardiográfica de 604 casos. Tese de doutorado, Universidade Federal do Rio de Janeiro, Rio de Janeiro, 1999.
XAVIER, S. S. e cols. Incidência e preditores de morte súbita na cardiopatia chagásica crônica com função sistólica preservada. Revista da SOCERJ. v. set/out, p. 457- 463, 2005.
XAVIER, S. S. e cols. Mecanismo de morte e grau de acometimento miocárdico na fase crônica da doença de Chagas. Revista da SOCERJ. v. 20 mar/abril, f. 2, p. 133-139, 2007.
ZACKS, M. A. et al. An overview of chagasic cardiomyopathy:pathogenic importance of oxidative stress. Annals of the Brazilian Academy of Sciences, v. 77, n. 4, p. 695-715, 2005.