Olga Ferreira de Souza*, Silvia Helena Boghossian**
*Serviço de Arritmia, Eletrofisiologista e Estimulação Cardíaca – Rede D’Or Hospitais – Rio de Janeiro, RJ – Brasil
**Serviço de Eletrofisiologia – Hospital Universitário Pedro Ernesto – Universidade do Estado do Rio de Janeiro (UERJ) – Rio de Janeiro, RJ – Brasil
Fonte: C@rdiologia: Prática Clínica
A fibrilação atrial (FA) é uma doença progressiva, iniciando com a forma paroxística, evoluindo para persistente e, por fim, permanente. O fenômeno de remodelamento é responsável por essa evolução, ocasionando alterações estruturais (dilatação, fibrose, infiltração gordurosa, hipertrofia dos miócitos atriais, etc.) e bioquímicas (mudanças na distribuição, densidade e funcionamento de canais iônicos).
O diagnóstico da arritmia pode ser confirmado pelo registro da FA através do ECG basal, sistema Holter, teste ergométrico, monitor de eventos ou eletrogramas intracavitários dos dispositivos implantáveis. Em alguns casos a FA pode ser um achado de exame complementar e o paciente estar assintomático. A presença de fatores clínicos como: idade avançada, HAS, diabetes mellitus (DM), insuficiência cardíaca congestiva (ICC), infarto agudo do miocárdio (IAM), valvopatia (reumática ou não) e cirurgia cardiotorácica estão associados à maior prevalência de FA.
Fatores de risco como obesidade, síndrome metabólica, apneia do sono, estatura elevada e excesso de atividade física também são considerados fatores para a ocorrência de FA.
Para o diagnóstico de síndrome metabólica são necessários pelo menos três dos cinco fatores: obesidade visceral, hipertensão arterial, hipertrigliceridemia, níveis baixos de colesterol HDL e glicemia de jejum >110mg/dl. O estado pró-inflamatório, o estresse oxidativo e a dilatação do AE são fatores comuns na patogenia da síndrome metabólica e da HAS e no mecanismo da FA, induzindo o processo de remodelamento atrial.
A síndrome da apneia obstrutiva no sono acarreta: hipoxemia, hipercapnia, tônus simpático aumentado, oscilações bruscas da pressão arterial, pressão negativa adicional sobre as câmaras cardíacas ativando canais iônicos atriais modulados por estiramento. Essas alterações contribuem para o processo de remodelamento atrial favorecendo a ocorrência de FA.
A prevenção de novos surtos e o tratamento dos fatores associados é fundamental para a interrupção do remodelamento atrial e controle da arritmia. Se o tratamento farmacológico para prevenção da arritmia não for eficaz e será indicado à ablação por cateter, para controle adequado dos surtos de FA.
As complicações tromboembólicas, principalmente o acidente vascular encefálico (AVE), quando associadas à FA trazem graves consequências, aumentando a morbidade e a mortalidade. Pacientes com FA têm um risco cinco vezes maior de ocorrência de AVE, na ausência de anticoagulação. O risco de AVE na vigência de FA dobra a cada década de vida após os 55 anos de idade, sendo >25% a incidência em pacientes acima de 80 anos.
A incidência de FA se eleva com o envelhecimento da população, numa projeção de 3,1 novos casos (entre os homens) e 1,9 (nas mulheres) a cada 1000 pessoas por ano na faixa etária de 55-64 anos; de 38 casos e 31,4 casos, para homens e mulheres, respectivamente, nas idades entre 85 anos e 94 anos1. Psaty et al. observaram que negros têm a metade do risco de desenvolver FA em comparação aos brancos.
O estudo de Framingham avaliou o impacto da FA na incidência de AVE em 5070 participantes no período de seguimento de 34 anos. Os resultados desse estudo mostraram que o percentual de AVE atribuído à FA aumenta dramaticamente com a idade, sendo essa arritmia a maior causa de AVE em idosos. O risco de ocorrência de AVE é o mesmo nas formas de apresentação da FA paroxística, persistente ou permanente (3,2% x 3,3%) e o risco se mantém quando a arritmia se apresenta de forma assintomática.
Portanto o envelhecimento da população, a presença de fatores que aumentam o risco de AVE, comum em pacientes idosos, como HAS, DM, ICC e IAM e a maior prevalência de FA nessa população têm sido motivo de grande preocupação, especialmente para os cardiologistas e neurologistas que apontam para uma elevada prevalência de FA e AVE para as próximas décadas.
A identificação de fatores que predispõem à ocorrência de FA e de fenômenos tromboembólicos tem sido analisada em diversos estudos que tentam buscar preditores de maior risco, selecionando aqueles pacientes que vão se beneficiar com a terapia antitrombótica e reduzindo assim a expectativa dramática de elevado número de AVE por FA nos próximos anos.
Na década de 1990 vários estudos randomizados foram realizados em pacientes com FA não valvar. Foram analisados cerca de 20.000 pacientes durante um período médio de 1,6 anos, com o objetivo de avaliar o benefício da terapia antitrombótica. O resultado desses estudos mostrou que o tratamento anticoagulante (com antagonistas da vitamina K, especialmente a varfarina) em pacientes com FA não valvar reduziu a incidência de AVE em cerca de 70%, com risco anual de AVE de 1,4% contra 4,5% com placebo. Essa redução do risco foi aproximadamente de 84% em mulheres e de 60% em homens, contribuindo para redução de 33% da mortalidade total (p=0,01) e em 48% dos eventos combinados: AVE, embolia sistêmica e óbitos (p<0,001). Grande meta-análise, incluindo 13 principais estudos de terapia antitrombótica na FA, concluiu que o tratamento com a varfarina reduziu significativamente a ocorrência tanto de AVE quanto de embolização sistêmica. O tratamento com ácido acetilsalicílico (AAS) previne bem menos que a varfarina e reduziu em apenas 22% as complicações tromboembólicas. Dentre os diversos esquemas de avaliação clínica para a estratificação de risco de tromboembolismo na FA, o CHADS2 (Cardiac failure, Hypertension, Age, Diabetes, Stroke) incluiu aspectos de diversas publicações, no qual a história de AVE ou ataque isquêmico transitório recebe 2 pontos e idade acima de 75 anos, HAS, DM ou IC recente recebem 1 ponto cada (Quadro 1). O escore 0 é considerado baixo risco; escore 1-2, moderado risco; e >2, alto risco. Escores mais altos relacionam-se com maiores taxas de ocorrência de AVE. Escores ≥2 devem receber anticoagulação. Para se obter os efeitos desejados com a anticoagulação, é extremamente importante a monitorização periódica e confiável do INR.
Quadro 1
Critério CHADS2 para identificação de pacientes portadores de FA e risco de eventos tromboembólicos
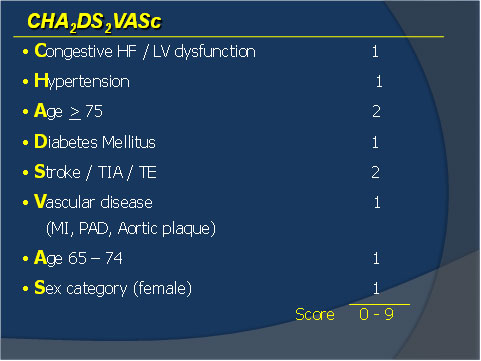
As diretrizes europeias e americanasque orientam o tratamento de FA associaram ao critério CHADS2 mais alguns fatores que também estão relacionados à maior chance de ocorrência de AVE. Esse critério foi denominado de CHA2DS2-VASC (Quadro 3 e Tabela 1); nos pacientes com maiores pontuações, observou-se maior taxa de AVE. Os fatores de risco foram classificados em: maiores e não maiores.
Quadro 2
Critério CHA2DS2-VASCpara a identificação de pacientes portadores de FA e risco de eventos tromboembólicos
Fonte: European Heart Rhythm Association
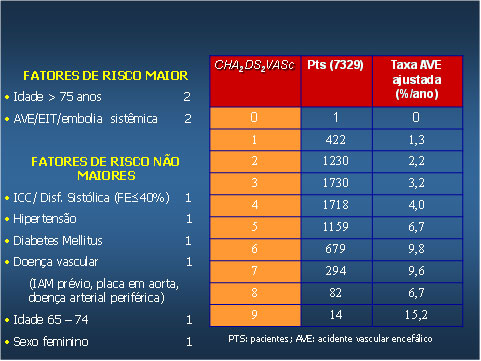
Tabela 1
Fatores de risco maior e não maior para a ocorrência de AVE e eventos tromboembólicos em pacientes com FA não valvar
Fonte: European Heart Rhythm Association
A doença vascular aterosclerótica foi incorporada como importante fator de risco para eventos tromboembólicos. Diversos estudos anteriores já tinham ressaltado o risco de AVE em pacientes com IAM, porém a presença de infarto prévio não era considerada quando se avaliava o risco de AVE no paciente com FA. A presença de placas complexas, na aorta ascendente ou torácica, também confere um prognóstico ruim nos pacientes com FA e representam fatores de risco independentes. Uma informação nova, de grande relevância clínica, foi a identificação de que o sexo feminino representa grupo de risco para a ocorrência de eventos tromboembólicos. A idade acima de 75 anos é um dos critérios utilizados pelo CHADS2, porém o risco de AVE e eventos tromboembólicos inicia-se no paciente >65 anos, sendo este risco contínuo à medida que se associam outros fatores de risco e a arritmia se torna mais frequente. No novo critério do CHA2DS2-VASC a idade acima de 75 anos passou a contar 2 pontos.
Em resumo, a utilização dos critérios do CHADS2 permite a identificação de pacientes de alto risco; e a associação do CHA2DS2-VASC a seleção dos pacientes de baixo risco que não eram contemplados anteriormente.
Leitura Recomendada
- Wijffels MC, Kirchhof CJ, Dorland R, Allessie MA. Atrial fibrillation begets atrial fibrillation. A study in awake chronically instrumented goats. Circulation. 1995;92(7):1954-68.
- Tieleman RG. The pathophysiology of maintenance of atrial fibrillation. Pacing Clin Electrophysiol. 2003;26(7 Pt 2):1569-71.
- Lévy S, Breithardt G, Campbell RW, Camm AJ, Daubert JC, Allessie M, et al. Atrial fibrillation: current knowledge and recommendations for management. Working Group on Arrhythmias of the European Society of Cardiology. Eur Heart J. 1998;19(9):1294-320.
- Falk RH. Atrial fibrillation. N Engl J Med. 2001;344(14):1067-78. Erratum in: N Engl J Med. 2001;344(24):1876.
- Magnani JW, Lopez FL, Soliman EZ, Maclehose RF, Crow RS, Alonso A. P wave indices, obesity, and the metabolic syndrome: the atherosclerosis risk in communities study. Obesity (Silver Spring). 2012;20(3):666-72.
- · Watanabe H, Tanabe N, Watanabe T, Darbar D, Roden DM, Sasaki S, et al. Metabolic syndrome and risk of development of atrial fibrillation: the Niigata preventive medicine study. Circulation. 2008;117(10):1255-60. Erratum in: Circulation. 2010;122(7):e433.
- Jibrini MB, Molnar J, Arora RR. Prevention of atrial fibrillation by way of abrogation of the renin-angiotensin system: a systematic review and meta-analysis. Am J Ther. 2008;15(1):36-43.
- Gami AS, Hodge DO, Herges RM, Olson EJ, Nykodym J, Kara T, et al. Obstructive sleep apnea, obesity, and the risk of incident atrial fibrillation. J Am Coll Cardiol. 2007;49(5):565-71.
- Fuster V, Rydén LE, Cannom DS, Crijns HJ, Curtis AB, Ellenbogen KA,et al; Task Force on Practice Guidelines, American College of Cardiology/American Heart Association; Committee for Practice Guidelines, European Society of Cardiology; European Heart Rhythm Association; Heart Rhythm Society. ACC/AHA/ESC 2006 Guidelines for the Management of Patients with Atrial Fibrillation — executive summary: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines (Writing Committee to revise the 2001 Guidelines for the Management of Patients with Atrial Fibrillation). Eur Heart J. 2006;27(16):1979-2030. Erratum in: Eur Heart J. 2007;28(20):2046.
- Alboni P, Botto GL, Baldi N, Luzi M, Russo V, Gianfranchi L, et al. Outpatient treatment of recent-onset atrial fibrillation with the “pill-in-the-pocket” approach. N Engl J Med. 2004;351(23):2384-91.
- Wyse DG, Waldo AL, DiMarco JP, Domanski MJ, Rosenberg Y, Schron EB, et al; Atrial Fibrillation Follow-up Investigation of Rhythm Management (AFFIRM) investigators. A comparison of rate control and rhythm control in patients with atrial fibrillation. N Engl J Med. 2002;347(23):1825-33.
- Hart RG, Halperin JL. Atrial fibrillation and thromboembolism: a decade of progress in stroke prevention. Ann Intern Med. 1999;131(9):688-95.
- Dawber TR, Kannel WB, Lyell LP. An approach to longitudinal studies in a community: the Framingham Study. Ann N Y Acad Sci. 1963;107:539-56.
- Feinberg WM, Blackshear JL, Laupacis A, Kronmal R, Hart RG. Prevalence, age distribution, and gender of patients with atrial fibrillation. Analysis and implications. Arch Intern Med. 1995;155(5):469-73.
- Psaty BM, Manolio TA, Kuller LH, Kronmal RA, Cushman M, Fried LP, et al. Incidence of and risk factors for atrial fibrillation in older adults. Circulation. 1997;96(7):2455-61.
- Benjamin EJ, Wolf PA, D’Agostino RB, Silbershatz H, Kannel WB, Levy D. Impact of atrial fibrillation on the risk of death: the Framingham Heart Study. Circulation. 1998;98(10):946-52.
- Gorter JW. Major bleeding during anticoagulation after cerebral ischemia: patterns and risk factors. Stroke Prevention In Reversible Ischemia Trial (SPIRIT). European Atrial Fibrillation Trial (EAFT) study groups. Neurology. 1999;53(6):1319-27.
- Dentali F, Douketis JD, Lim W, Crowther M. Combined aspirin-oral anticoagulant therapy compared with oral anticoagulant therapy alone among patients at risk for cardiovascular disease: a meta-analysis of randomized trials. Arch Intern Med. 2007;167(2):117-24.
- Lip GY, Edwards SJ. Stroke prevention with aspirin, warfarin and xilmelagatran in patients with non-valvular atrial fibrillation: a systematic review and meta-analysis. Thromb Res. 2006;118(3):321-33.
- Watson T, Kakar P, Lip GY. Stroke risk stratification in atrial fibrillation: something to EXAMINE more closely. Int J Clin Pract. 2007;61(1):6-9. Erratum in: Int J Clin Pract. 2007;61(3):534.
- Fuster V, Rydén LE, Cannom DS, Crijns HJ, Curtis AB, Ellenbogen KA, et al; American College of Cardiology/American Heart Association Task Force on Practice Guidelines; European Society of Cardiology Committee for Practice Guidelines; European Heart Rhythm Association; Heart Rhythm Society. ACC/AHA/ESC 2006 Guidelines for the Management of Patients with Atrial Fibrillation: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines (Writing Committee to revise the 2001 Guidelines for the Management of Patients with Atrial Fibrillation): developed in collaboration with the European Heart Rhythm Association and the Heart Rhythm Society. Circulation. 2006;114(7):e257-354. Erratum in: Circulation.2007;116(6):e138.
- European Heart Rhythm Association; European Association for Cardio-Thoracic Surgery, Camm AJ, Kirchhof P, Lip GY, Schotten U, Savelieva I, Ernst S, et al. Guidelines for the Management of Atrial Fibrillation: the Task Force for the Management of Atrial Fibrillation of the European Society of Cardiology (ESC). Eur Heart J. 2010;31(19):2369-429. Erratum in: Eur Heart J. 2011;32(9):1172.
- Wann LS, Curtis AB, January CT, Ellenbogen KA, Lowe JE, Estes NA 3rd, et al; ACCF/AHA Task Force Members. 2011 ACCF/AHA/HRS focused update on the management of patients with atrial fibrillation (updating the 2006 guideline): a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation. 2011;123(1):104-23. Erratum in: Circulation. 2001;124(5):e173.