MAUARA SCORSATTO
Doutoranda do Programa de Pós Graduação em Ciências Cardiovasculares da Universidade Federal do Rio de Janeiro
As doenças crônicas não transmissíveis (DCNT) são responsáveis por uma parcela grande e crescente da carga de doenças no Brasil. Em 2007, foram responsáveis por cerca de 72% das mortes no país1 destas, as doenças cardiovasculares (DCV) representaram quase um terço dos óbitos.2
A DCV é a primeira causa de morte em países desenvolvidos e em desenvolvimento e apesar de sua diminuição, continuam sendo a principal causa de morte no Brasil.1
Estratificar pacientes com risco para DCV permanece um desafio, especialmente para aqueles com risco baixo ou intermediário.3
Estudo mostrou que em 2006, as DCVs acometeram 36,3% dos indivíduos participantes de 12 grupos populacionais. A hipertensão arterial sistêmica obteve maior prevalência com cerca de 33,3%, seguida das doenças coronarianas (7,6%), infarto agudo do miocárdio (3,6%) e acidente vascular encefálico (2,9%).4
O fator de risco para DCV é definido como uma característica biológica ou um comportamento que aumenta a possibilidade de desenvolver a DCV.5 São vários os fatores de risco para DCV, sendo os principais: hipertensão arterial sistêmica, dislipidemia, diabetes mellitus, tabagismo, obesidade e sedentarismo.6 No caso da obesidade, nas últimas décadas, o aumento da prevalência da mesma em âmbito mundial, tem colocado esse fator de risco como um dos maiores problemas de saúde pública da humanidade. Trata-se de doença crônica de caráter multifatorial, bem como fator de risco para ocorrência de várias outras doenças crônicas. Fatores ambientais e estilos de vida não saudáveis, como hábitos alimentares inadequados e sedentarismo, desempenham um papel preponderante na ocorrência desta enfermidade, apesar de os fatores genéticos atuarem como cofatores, aumentando a susceptibilidade de ganho de peso corporal.7
Nos últimos anos, foram identificados outros fatores de risco para as DCV, como a hiperhomocisteinemia (Hhcy), cujo estudo pode ampliar o entendimento sobre os mecanismos fisiopatológicos da aterosclerose e possibilitar o desenvolvimento de novas medidas preventivas ou terapêuticas. Apesar da grande quantidade de dados epidemiológicos apresentando a correlação entre Hhcy e aumento do risco para doenças vasculares, os mecanismos pelos quais a Hhcy contribui para a aterogênese e trombogênese são hipotéticos e controversos.8
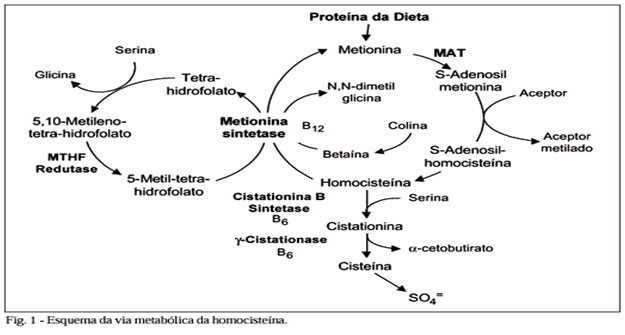
A homocisteína (Hcy) é um aminoácido sulfurado formado a partir da demetilação de um aminoácido essencial, a metionina. No plasma a Hcy encontra-se na forma oxidada e ligada a proteínas plasmáticas, principalmente a albumina.9 O metabolismo da Hcy envolve duas principais reações: a transulfuração e a remetilação (Figura 1)10. Desta forma, quando há excesso de metionina da dieta, a Hcy é transulfurada em uma reação catalisada pela enzima cistationa β-sintase, tendo como co-fator a piridoxina, sendo irreversivelmente convertida em cistationina. Em condições de balanço negativo de metionina, a Hcy é remetilada, reação catalisada pela enzima metionina sintase que tem como co-fator a cobalamina. Esta reação é acoplada a reação que converte a 5-metilenotetrahidrofolato (MTHF), a tetrahidrofolato que então exerce sua função dentro das células. A metilenotetrahidrofolato redutase (MTHFR), é considerada uma enzima chave nesta reação, pois catalisa a redução do ácido fólico – 5,10 MTHF a 5- MTHF.10,11 Assim o envolvimento da enzima MTHFR nos metabolismos da metionina e Hcy possui relação com as concentrações de Hcy e considera-se que a Hhcy seja um novo e relevante marcador de risco independente para as doenças vasculares oclusivas precoces.12,13 Os polimorfismos da MTHFR podem atuar aumentando a predisposição genética para tais eventos.14
Estudos demonstram associação relevante entre a Hhcy, os polimorfismos da enzima MTHFR, doença vascular, trombose, aterosclerose e doença arterial coronariana (DAC). 12,13,14 Pesquisas relacionando a Hhcy com a aterosclerose, sugerem que elevadas concentrações de Hcy podem promover a disfunção endotelial.15,16,17 A gênese da lesão vascular na presença de Hhcy parece incluir lesão da célula endotelial, crescimento da musculatura lisa vascular, maior adesividade plaquetária, deposição de LDL colesterol oxidado na parede vascular e ativação direta da cascata de coagulação.9
Em estudo que analisou os efeitos da Hhcy na formação e na estrutura das fibras fibrina, verificou-se que estas eram mais curtas, compactas e resistentes à ação do sistema fibrinolítico.18 Um dos mecanismos pelos quais a Hhcy parece favorecer a proliferação das células musculares lisas é a inativação do óxido nítrico (ON) a partir de peróxidos de lipídios produzidos na oxidação da Hcy. Na ausência do ON o endotélio fica vulnerável aos danos promovidos pela Hhcy e na circulação periférica podem ocorrer estresse oxidativo e efeitos pró-inflamatórios com síntese do fator de necrose tumoral α e disfunção endotelial.19,20,21,22,23
As informações atualmente disponíveis evidenciam que a suplementação combinada de folato, cobalamina e piridoxina pode ser utilizada no tratamento da Hhcy. De fato, a suplementação, ou a fortificação, ou a adequação dietética isolada do ácido fólico promove redução eficiente da homocisteína (Hcy) plasmática e configura-se um procedimento custo-efetivo que apresenta eficácia, sem reações adversas, tratando-se, portanto, de um coadjuvante terapêutico com relação risco-benefício bastante favorável no controle da homocisteinemia.8 O plasma possui formas reduzidas (1%) e oxidadas (98 a 99%) deste aminoácido, sendo que de 80 a 90% da forma oxidada se encontra ligada à albumina.24
Metanalise mostrou que a suplementação com ácido fólico, entre 0,5 mg/d a 15 mg/d, com duração de 2 a 6 anos, pode reduzir efetivamente o risco de acidente vascular cerebral na prevenção primária.25
Pesquisadores dos Estados Unidos, avaliaram a influência da variante 677C>T do gene da MTHFR na homocisteinemia antes da fortificação dos cereais com ácido fólico (anos 1985 e 1992) e após a fortificação (ano 2000) em ambos, caucasianos (n=844) e afro-americanos (n=587) em uma tentativa de discernir os efeitos da nutrição e da genética sobre as concentrações de Hcy nas diferentes etnias. Os resultados mostraram que a fortificação obrigatória do ácido fólico melhorou o estado nutricional de folato, com um aumento aproximado de 3 vezes nas concentrações de folato pós-fortificação. Simultaneamente, as concentrações de hcy pós-fortificação diminuíram significativamente em relação aos anos pré-fortificação em ambas as populações. A elevada prevalência de deficiência de folato em 1985 (26,2% em caucasianos e 43,6% em afro-americanos) diminuiu em 2000 para 1% (0,4% em caucasianos e 1,4% em afro-americanos) e a porcentagem de participantes com Hhcy moderada (>13µmol/L) diminuiu de 15,3% em 1985 para 4,5% em 2000 nos caucasianos e de 16,9% para 6,5% em afro-americanos. Além disso, indivíduos homozigotos 677TT caucasianos, tiveram significativamente concentrações mais elevadas de Hcy em comparação com homozigotos 677CC nos anos de 1992 e 2000. No entanto, a diferença absoluta entre 677TT e 677CC diminuiu de 2,5 mmol / L em 1985, para 0,7mmol / L em 2000. Em afro-americanos, portadores de pelo menos um alelo 677T tiveram concentrações significativamente mais elevadas de Hcy em comparação com homozigotos 677CC nos anos de 1985 e 1992. Porém no ano 2000 a diferença não foi mais significativa.26
Em estudo realizado na UFRJ, mo grupo pré-fortificação, 71,1% das mulheres apresentaram ingestão dietética de ácido fólico menor que a atual recomendação para adultos (<400 µg/dia), o que esperado já que dados de um estudo conduzido pelo Instituto Brasileiro de Geografia e Estatística, 2002-2003, mostrou que a dieta do brasileiro era pobre em frutas e vegetais, a principais fontes de ácido fólico.2 Por outro lado, no grupo pós-fortificação, apenas 16,4% das mulheres apresentaram ingestão abaixo das recomendações, possivelmente pela fortificação das farinhas de milho e trigo com ácido fólico e pelo aumento de 9.52% no consumo de frutas e de 10% no consumo de legumes e verduras, pela população brasileira, em comparação ao período de 2002-2003. Além disso, no grupo pré-fortificação, 42.1% das mulheres apresentaram Hhcy ( >10 µmol/L) contra apenas 9.1 % do grupo pós-fortificação. As diferenças que foram encontradas entre os dois grupos, para as variáveis contínuas: colesterol total, HDL col, triglicerídios e consumo dietético de fibra, explica-se em parte, pelo fato do consumo de ácido fólico estar associado à maior ingestão de fibras, proporcionando possivelmente maior proteção cardiovascular no grupo pós-fortificação. As concentrações plasmáticas de homocisteína diminuem proporcionalmente ao aumento do consumo de ácido fólico, em ambos os grupos, resultados compatíveis com estudos citados anteriormente. 27
Assim, os dados disponíveis para o papel de Hhcy em DCV são a favor da hipótese de que a fortificação das farinhas de milho e trigo com ácido fólico contribuiriam para a redução de risco cardiovascular, pelo menos ao nível de prevenção primária.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Schmidt MI, Duncan BB, Silva GA, Menezes AM, Monteiro, CA, Barreto SM, Chor D, Menezes, PR. Doenças crônicas não transmissíveis no Brasil: carga e desafios atuais. Saúde no Brasil 4. 2011; 6736: 60135-60139.
2. Malta DC, Moura EC, Castro AM, Cruz DKA, Morais Neto OL, Monteiro CA. Padrão de atividade física em adultos brasileiros: resultados de um inquérito por entrevistas telefônicas, 2006. Epidemiol. Serv. Saúde. 2009; 18.
3. Berger JS, Jordan CO, Lloyd-Jones D, Blumenthal RS. Screening for cardiovascular risk in asymptomatic patients. Journal of the American College of Cardiology. 2010; 55: 1169-1176.
4. Heart Disease and Stroke Statistics 2009 Update: A Report From the American Heart Association Statistics Committee and Stroke Statistics Subcommittee. Circulation. 2009;119: 480-486.
5. Terrados N, Valcárcel G, Venta R. New cardiovascular risk factors and physical activity. Apunts Med. Esport. 2010; 45: 201-208.
6. Houston MC, Fazio S, Chilton FH, Wise DE, Jones KB, Barringer TA, Bramlet DA. Nonpharmacologic Treatment of Dyslipidemia. Progress in Cardiovascular Diseases. 2009; 52: 61-94.
7. Vigitel Brasil 2008: vigilância de fatores de risco e proteção para doenças crônicas por inquérito telefônico/ Ministério da Saúde, Secretaria de Vigilância em Saúde, Secretaria de Gestão Estratégica e Participativa. – Brasília : Ministério da Saúde, 2009
8. Venâncio LS, Burini RC, Yoshida WB. Tratamento dietético da hiperhomocisteinemia na doença arterial periférica J. Vasc. Bras. 2010, 9.
9. Neves LB, Macedo DM, Lopes AC. Homocisteína. J Bras Patol Med Lab. 2004; 40: 311-320.
10. Bydlowski SP, Magnanelli AC, Chamone DAF. Hiperhomocisteinemia. Arq. Bras. Cardiol. 1998; 71.
11. Couto AL, Hirata MH, Kim CA, Guerra-Shinohara EM, Nonoyama K, Hirata RD. Metabolics effects of C677T and A1298C mutations at the MTHFR gene in Brazilian children whit neural tube defects. Clinical Chimica Acta. 2002; 318: 139-143.
12. Arruda VR, Von-Zoem PM, Chiaparini LC, Annichino-Bizzacchi JM, Costa FF. The mutation Ala677-T in the methylene tetrahydrofolate reductase gene among distinct ethinic groups in Brazil. American Journal of Medical Genetics.1998; 78: 332-335.
13. Klerck M, Verhoef P, Clarke R, Blom HJ, Kok FJ, Schouten E, MTHFR STUDIES COLLABORATION GROUP. The Journal of the American Medical Association. 2002; 228: 2023-2031.
14. Sazci A, Ergul E, Tuncer N, Akpinar G, Kara I. Methylenetetrahydrofolate reductase gene polymorphisms are associated with ischemic and hemorrhagic stroke: Dual effect of MTHFR polymorphisms C677T and A1298C. Brain Research Bulletin. 2006; 71: 45–50.
15. Weiss N, Keller C, Hoffmann U, Loscalzo J. Endothelial dysfunction and Atherothrombosis in mild hyperhomocysteinemia. Vascular Medicine. 2002; 7: 227-239.
16. Lentz SR. Mechanisms of homocysteine-induced atherothrombosis. J Thromb Haemost. 2005; 3: 1646–54.
17. Uehara SK, Baluz K, Rosa G. Possíveis Mecanismos Trombogênicos da Hiperhomocisteinemia e o seu tratamento nutricional. Revista de Nutrição. 2005; 18: 743-751.
18. Lauricella AM, Quintana IL, Kordich LC. Effects of homocysteine thiol group on fibrin networks: another possible mechanism of harm. Thromb Res. 2002; 107: 75-9.
19. Welch GN, Upchurch JR, Loscalzo J. Hyperhomocysteinemia and atherothrombosis. Ann N Y Acad Sci.1997; 811:48-58.
20. Faraci FM. Hyperhomocysteinemia: a million ways to lose control. Arterioscler Thromb Vasc Biol. 2003; 23: 371–373.
21. Ungvari Z, Csiszar A, Edwards JG, Kaminski PM, Wolin MS, Kaley G, Koller A. Increased superoxide production in coronary arteries in hyperhomocysteinemia: role of TNF[alpha], NAD(P)H oxidase and iNOS. Arterioscler Thromb Vasc Biol. 2003; 23: 418–424.
22. Loscalzo J. Oxidant stress: a key determinant of atherothrombosis. Biochem Soc Trans.2003; 31: 1059–1061.
23. Eberhardt RT, Forgione MA, Cap A, Leopold JA, Rudd MA, Trolliet M, Heydrick S, Stark R, Klings ES, Moldovan NI, Yaghoubi M, Goldschmidt-Clermont PJ, Farber HW, Cohen R, Loscalzo J. Endothelial dysfunction in a murine model of mild hyperhomocysteinemia. J Clin Invest. 2000; 106: 483–491.
24. Brustolin S, Giugliane R, Félix TM. Genetics of homocysteine metabolism and associated disorders. Braz J Med Biol Res. 2010; 43.
25. Wang X, Qin X, Demirtas H, Li J, Mao G, Huo Y, Sun N, Liu L, Xu X. Efficacy of folic acid supplementation in stroke prevention: a metaanalysis. Lancet. 2007;369:1876–82.
26. Tsai, M. Y.; Loria, C.M.; Cao, J.; Kim, Y.; Siscovick, D.; Schreiner, P.J.; Hanson N. Q. Clinical Utility of Genotyping the 677C>T Variant of Methylenetetrahydrofolate Reductase in Humans Is Decreased in the Post-Folic Acid Fortification Era. The Journal of Nutrition. 139: 33–37, 2009.
27- Scorsatto M, Uehara SK, Luiz RR, Oliveira GM, Rosa G. Fortification of flours with folic acid reduces homocysteine levels in Brazilian women. Nutrition Research 2011; 31: 889-895.